Messung der Transfektionseffizienz von kultivierten Zellen
- Was ist Transfektion?
- Transfektionsprinzipien
- Verbesserung der Transfektionseffizienz
- Transfektionseffizienz messen
Was ist Transfektion?
Transfektion ist ein Prozess, bei dem Nukleinsäuren in tierische Zellen eingebracht werden, um die Zellen dazu zu bringen, spezifische Gene einzubauen, um ein zu untersuchendes Protein zu exprimieren. Nukleinsäuren, die durch Transfektion eingebaut werden, werden als Fremdnukleinsäuren bezeichnet. Gene können ohne ein Virus in die Zielzellen eingebracht werden, anders als bei der Transduktion, die ein Virus zur Übertragung der DNA benötigt.
Nukleinsäuren können temporär eingeführt werden, um ein Protein zu exprimieren, oder sie werden zusammen mit dem Genom der Wirtszelle repliziert. Die temporäre Einbringung von Nukleinsäuren wird als transiente Transfektion bezeichnet und die Transfektion mit gleichzeitiger Nukleinsäurereplikation als stabile Transfektion. So kann die Transfektion genutzt werden, um die spezifische Genexpression in den transfizierten Zellen zu verstärken oder zu hemmen, oder um rekombinante Proteine zu erzeugen.
Transfektionsprinzipien
Die Zellmembran, die aus einer Lipid-Doppelschicht besteht, in welcher Proteine eingebaut sind, hat eine negative Ladung, die verhindert, dass große, negativ geladene Nukleinsäuren (Moleküle) wie DNA und RNA hindurchtreten können. Um die Transfektion zu ermöglichen, müssen die Nukleinsäuren auf andere Weise die Zellmembran passieren. Andere Methoden, um Nukleinsäuren durch die Zellmembran passieren zu lassen, sind unter anderem chemische, biologische und physikalische Methoden, wobei es jeweils unterschiedliche Funktionsprinzipien gibt. In diesem Abschnitt werden die einzelnen Methoden, einschließlich ihrer Funktionsprinzipien und ihrer Vor- und Nachteile, am Beispiel der Einbringung eines Gens in eine Zelle erläutert.
Chemische Transfektion
Bei der chemischen Transfektion wird die negative Ladung der Nukleinsäure zu einer positiven Ladung geändert oder neutralisiert. Zu den Methoden gehören die Lipofektion und die Kalziumphosphat-Kopräzipitation, wobei die Lipofektion die am häufigsten verwendete Methode ist.
Bei der Lipofektionsmethode werden kationische Lipidreagenzkomplexe durch elektrostatische Wechselwirkungen zwischen positiv geladenen synthetischen Lipidreagenz-Kopfgruppen und negativ geladenen Nukleinsäuren aufgebaut. Die kationischen Lipid-Reagenzkomplexe interagieren mit der negativ geladenen Zellmembranoberfläche, um Nukleinsäuren effizient in die Zelle einzubringen. Dadurch kann die Zelle die Nukleinsäuren über Endozytose aufnehmen, bevor sie in das Zytoplasma abgegeben werden. Die Lipofektion ist eine einfache und leichte Transfektionsmethode mit geringer Toxizität und hervorragender Bedienbarkeit.
Diese Methode ermöglicht eine effiziente Aufnahme nicht nur von Nukleinsäuren für verschiedene Zelltypen, sondern auch von Proteinen, DNA und RNA. Die Lipofektionsmethode kann auch für transiente und stabile Transfektionen verwendet werden.
Bei der chemischen Transfektion müssen jedoch die Bedingungen für den Zelltyp und die Kultur geeignet sein, was zu einer geringeren Transfektionseffizienz als bei physikalischen und biologischen Methoden führt.
Biologische Transfektion
Bei der biologischen Transfektionsmethode werden Viren eingesetzt. Die virusbasierte Transfektion ist hocheffizient, weil sie die Infektiosität eines Virus ausnutzt. Diese Methode wird für die Überexpression von Proteinen in Zellen verwendet, für die die Aufnahme von Nukleinsäuren schwierig ist. Diese Methode ist ideal für die In-vivo-Transfektion und damit die am häufigsten verwendete Methode in der klinischen Forschung. Adenoviren, Retroviren und Lentiviren werden für die In-vivo-Genaufnahme verwendet.
Bei der biologischen Transfektion wird während des Kopierens der Gene ein rekombinantes Virus erzeugt, und die mit Genen mit Helferfunktion transfizierten Zellen werden aufgenommen und vermehrt, bevor nur der virale Vektor extrahiert wird. Der virale Vektor, der die einzubauenden Gene enthält, wird dann erzeugt, um das gewünschte genetische Material in die Zelle zu bringen.
Obwohl die virusbasierte Transfektion für lebende Organismen, z. B. für den Einsatz in Tierversuchen, sehr anpassungsfähig ist, kann die Vorbereitung der Viren schwierig sein und erfordert die Einhaltung von Biosicherheitsstandards. Problematisch sind auch Mutationen bei der Einbringung und die Inaktivierung durch das Immunsystem.
Physikalische Transfektion
Bei der physikalischen Transfektion wird die Oberfläche der Zelle stimuliert, um die Nukleinsäure durch die Zellmembran einzuschleusen. Zu den Methoden gehören Elektroporation, Mikroinjektion und Laserbearbeitung, wobei die Elektroporation die am häufigsten verwendete Methode ist. Bei der Elektroporation werden die Nukleinsäuren und die Zellen in einer leitfähigen Lösung suspendiert und befinden sich dann zwischen einer Anode und einer Kathode. Anschließend werden kontinuierlich elektrische Impulse angelegt, die kleine Löcher in der Zellmembran erzeugen. Diese Löcher werden dann genutzt, um extrazelluläre Nukleinsäuren mit einer elektrischen Ladung – wie DNA und RNA – durch die Zellmembran einzuschleusen.
Die physikalische Transfektion bietet eine hohe Transfektionseffizienz und ist einfacher als chemische und biologische Transfektionsmethoden. Allerdings können die elektrischen Impulse zum Zelltod führen, möglicherweise schließen sich die durch die elektrischen Impulse erzeugten Löcher nicht, was zu Zytotoxizität führt. Zudem sind für die physikalische Transfektion teure, spezialisierte Systeme erforderlich.
Verbesserung der Transfektionseffizienz
Die Transfektionseffizienz ist die Effizienz der Nukleinsäureaufnahme durch die Zielzellen. In diesem Abschnitt werden verschiedene, für die Verbesserung der Transfektionseffizient zu berücksichtigende Faktoren vorgestellt.
- Zelllebensfähigkeit und Passage
- Die Lebensfähigkeit der Zellen vor der Transfektion sollte mindestens 90% betragen. Die Passage, bei der die Zellen aus der Kultur in das neue Medium überführt werden, sollte außerdem innerhalb von 24 Stunden nach der Transfektion erfolgen. Beachten Sie auch, dass eine übermäßige Passage die Transfektionseffizienz negativ beeinflussen kann und dass Sie daher sorgfältig auf die Passagenanzahl achten sollten.
- Zellkulturen und Reagenzien
- Die Konfluenz, die den idealen Proliferationsstatus einer Zelle für die Transfektion angibt, variiert je nach Testzweck und -methode oder Zelltyp. Wenn die Konfluenz zu hoch ist, kann die Nukleinsäureaufnahme unzureichend sein oder die Transgenexpression kann reduziert sein. Wenn die Konfluenz zu niedrig ist, kann der interzelluläre Kontakt nicht stattfinden, was die Proliferation verhindert.
Das optimale Medium zum Wachsen der Zellen für die Transfektion hängt von den Zellen, den Reagenzien und dem Zelltypserum ab. Beim Einbringen von DNA in Stammzellen werden z. B. Reagenzien verwendet, die Nukleinsäuren in embryonale Stammzellen (ES-Zellen), induzierte pluripotente Stammzellen (iPS-Zellen), humane adulte Stammzellen und andere Zelltypen mit hoher Effizienz und geringer Toxizität einbringen können. Beim Einbringen von RNA in Stammzellen werden Reagenzien verwendet, die siRNA (small interfering RNA), mRNA (messenger RNA) und dsRNA (double-stranded RNA) einbringen und gleichzeitig die Stammzellen vor Abbau schützen können. - Auswahl der Transfektionsmethode
- Zu den Transfektionsmethoden gehören die chemische, die biologische und die physikalische Transfektion. Chemische und physikalische Transfektion werden häufig für die gezielte Transfektion von kultivierten Zellen verwendet. Die biologische Transfektion ist effektiv für die Transfektion von kultivierten Zellen und tierischen Zellen. Allerdings kann es bei der chemischen Transfektion je nach Zelltyp und -bedingungen zu Schwankungen in der Transfektionseffizienz oder chemischen Toxizität kommen, und die selektive Transfektion kann bei einigen Zellen schwierig sein. Die physikalische Transfektion hingegen erfordert spezielle Instrumente und Geräte, und die Nukleinsäuren werden leicht beschädigt. Die biologische Transfektion birgt auch das Risiko von Kontaminationen, Mutationen beim Einbringen von therapeutischen Genen in die Zellchromosomen sowie immunitätsbedingte Inaktivierung.
Da jede Methode Nachteile hat, ist die Auswahl einer Transfektionsmethode mit hoher Transfektionseffizienz und hoher Reproduzierbarkeit für die spezifische Kombination von Transfektionszellen und Zielzellen unerlässlich. - Weitere Faktoren
- Die Transfektionseffizienz variiert auch je nachdem, ob Seren oder Antibiotika verwendet werden. Beim Einbringen von DNA beispielsweise erhöht die Kultivierung der Zellen in einem Medium mit Serum die Effizienz. Die Durchführung der transienten Transfektion in einem Medium mit Antibiotika erhöht ebenfalls die Transfektionseffizienz.
Antibiotika können jedoch auch Zytotoxizität verursachen, die sich negativ auf die Zellen auswirken und die Transfektionseffizienz verringern kann. Außerdem können sowohl DNA- als auch RNA-Vektoren für die transiente Transfektion verwendet werden, aber für die stabile Transfektion können nur DNA-Vektoren verwendet werden.
Transfektionseffizienz messen
Eine allgemeine Methode zur Messung der Transfektionseffizienz ist Verwendung eines Fluoreszenzmikroskops. Die Transfektionseffizienz wird gemessen, indem die Gesamtzahl der betrachteten Zellen und die Anzahl der fluoreszenzemittierenden Zellen ermittelt und diese Werte analysiert werden.
Messung der Transfektionseffizienz
Bei der Geneinführung wird eine mit einem Wachstumsmedium für die richtige Zelldichte vorbereitete Zellsuspension auf eine Mikrotiterplatte aufgetragen. Diese wird anschließend inkubiert. Der vorbereitete Komplex wird dann zu den Zellen gegeben. Nachdem die Mikrotiterplatte geschüttelt wurde, werden die Zellen erneut für 24 Stunden in einen Inkubator gegeben. Nach Ende der Inkubation lässt sich die Expression der Zellen betrachten, um die Transfektionseffizienz zu messen. Die Transfektionseffizienz wird üblicherweise mit einem Fluoreszenzfarbstoff und einem Fluoreszenzmikroskop gemessen.
Herausforderungen bei der Messung der Transfektionseffizienz
Das kompakte Fluoreszenzmikroskop BZ-X verfügt über eine integrierte Dunkelkammer, die es dem Anwender ermöglicht, Fluoreszenzaufnahmen auch in einem hell erleuchteten Raum durchzuführen. Das BZ-X extrahiert und quantifiziert Phasenkontrast-Bildkonturen selbst für kultivierte Zellen mit subtilen Helligkeitsunterschieden präzise und ermöglicht es dem Benutzer, einen Zellmaskenbereich für die Messung der Anzahl der Messziele und des Oberflächenverhältnisses in diesem Zielbereich festzulegen. Das BZ-X kann das Zellexpressionsniveau messen, um die Transfektionseffizienz quantitativ zu bestimmen, ohne dass eine separate Software erforderlich ist.
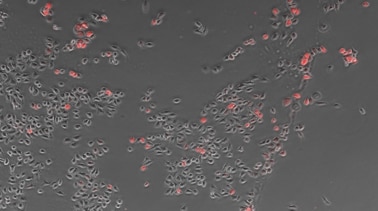


- Zelle
- 903
- Expression
- 89
- Effizienz
- 9,9%
Objektiv: CFI Plan Fluor DL 10x
Verwendung des kompakten Fluoreszenzmikroskops BZ-X
- Die Fluoreszenzbetrachtung kann überall durchgeführt werden, da keine separate Dunkelkammer benötigt wird. Zudem verhindert das KEYENCE-eigene Messprinzip Photobleaching, sodass Zellschäden minimiert werden.
- Phasenkontrastbilder und Overlays können erfasst werden.
- Selbst von einem Phasenkontrastbild kann mit dem KEYENCE-eigenen Messalgorithmus der Umriss von Zellen genau extrahiert werden.
- Die hybride Zellzählung kann verwendet werden, um Zellkerne als Auswahlbereiche festzulegen und fluoreszierende Proteine zu extrahieren, die in jedem Zellkern enthalten sind, und diese zu zählen.
- Weitere Beispiele für den Einsatz des kompakten Fluoreszenzmikroskops BZ-X in der Forschung:
- [Myelodysplastische Syndrome (MDS)] Stitching, Sectioning und die Z-Stapelfunktion als entscheidende Argumente für die Anschaffung des Fluoreszenzmikroskops BZ am Universitätsklinikum Düsseldorf
- [Neuropathologie] Perfekte Lösung für den diagnostischen Alltag in der Krankenversorgung und der klinischen Forschung am Institut für Neuropathologie der Charité in Berlin
- [Regenerative Medizin] Essentielle Bildgebung für die Betrachtung der gesamten Wirbelsäule
- [Gentherapie] Probenbetrachtung in der Hirnforschung
- [Behandlung von Herzkrankheiten] Einfache Betrachtung vom gesamten Rattenherz bis hin zu dessen Zellen
- [Krebsbehandlung] Fluoreszenzmikroskop mit integrierter Dunkelkammer verändert die Forschung in starkem Maße
- [Immunsystem] Beitrag der Modellreihe BZ zum Verständnis des pathologischen Asthmamodells
- [Biomaterialien] Förderung der Effizienz in der Forschung mit kompakten, benutzerfreundlichen Mikroskopen