Mikrokerntest
- Was ist ein Mikrokerntest?
- Typische Genotoxizitätstests, die in Kombination mit Mikrokerntests durchgeführt werden
- Betrachtung von Mikrokernen mit einem Fluoreszenzmikroskop
Was ist ein Mikrokerntest?
Im Folgenden werden Genotoxizitätstests (Mutagenitätstests), eine Art der Sicherheitsprüfung für Lebensmittel und Arzneimittel, erläutert und die Grundsätze des Mikronukleustests, eines typischen Genotoxizitätstests, dargestellt.
Genotoxizität und Genotoxizitätstests
Genotoxizität ist die Eigenschaft oder Wirkung von chemischen Stoffen oder Strahlungen, die mit den Chromosomen oder DNA-Proteinen in Zellen interagieren und Mutationen in diesen Strukturen verursachen. Selbst wenn ein chemischer Wirkstoff Gentoxizität aufweisen würde, würde diese Chemikalie allein nicht den Effekt verursachen. Wenn ein genotoxischer Stoff mit Körperzellen interagiert, hat dieser möglicherweise eine Toxizität, die zu Krebs oder anderen Krankheiten führen oder in einigen Fällen Erbkrankheiten auslösen kann, die über Generationen weitergegeben werden. Eine Eigenschaft, die eine irreversible, vererbbare Veränderung (Mutation) an der DNA hervorruft, wird als Mutagenität bezeichnet. Genotoxizität wird hingegen als weit gefasster Begriff verwendet, der auch die Eigenschaft beinhaltet, nicht vererbbare Veränderungen in der DNA und den Chromosomen zu induzieren.
Genotoxizitätstests (Mutagenitätstests) werden durchgeführt, um zu bewerten, ob ein chemischer Wirkstoff, der in einem Arzneimittel, einem Zusatzstoff, einer Agrarchemikalie oder einem allgemeinen chemischen Produkt verwendet wird, möglicherweise genotoxisch ist. Im Allgemeinen wird eine Prüfsubstanz einem Säugetier oder den kultivierten Zellen eines Säugetiers verabreicht und etwaige DNA-Schäden oder Chromosomenaberrationen aus der Wechselwirkung werden zur Bewertung der Toxizität untersucht. Das International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) legt Richtlinien für pharmazeutische Vorschriften fest, darunter auch internationale Richtlinien für die Genotoxizitätsprüfung von Arzneimitteln. In der Regel werden Genotoxizitätstests durchgeführt und die Testergebnisse gemäß den ICH-Richtlinien bewertet. Diese Richtlinien werden von Expertenarbeitsgruppen diskutiert und überarbeitet, wobei die Meinungen der Zulassungsbehörden der Länder und Gebiete, die dem ICH angehören, berücksichtigt werden.
Mikrokerntest
Ein Mikrokerntest ist ein Genotoxizitätstest, der das Vorhandensein von Mikrokernen in Zellen, denen eine Testsubstanz (Chemikalie usw.) verabreicht wurde, und die Häufigkeit von Zellen mit Mikrokernen unter normalen Zellen bewertet. Er wird als Genotoxizitätstest verwendet, um Chromosomenaberrationen zu identifizieren. Ein Mikrokern ist ein kleiner Kern, der sich immer dann bildet, wenn ein Fragment eines Chromosoms während der Zellteilung nicht in einen der Tochterkerne eingebaut wird, und zwar als Folge einer chromosomalen Aberration, die durch eine Wechselwirkung mit einer Chemikalie ausgelöst wurde.
Es gibt zwei Gruppen von Mikrokerntests, je nachdem, auf welche Zielzellen die Testsubstanz abgegeben wird:
- In-vivo-Mikrokern-Assays: Mikrokern-Assays an Säugetieren, wie chinesische Hamster, Mäuse und anderen Nagetieren
- In-vitro-Mikrokern-Assays: Mikrokern-Assays an kultivierten Säugetierzellen, wie CHL/IU-Zellen (Lungenfibroblastenzellen des chinesischen Hamsters)
Das Prinzip der Mikrokernbildung beim Mikrokerntest
Die folgende Abbildung zeigt das Prinzip, wie sich bei einem Mikrokerntest Mikrokerne in Zellen bilden, wenn eine Testsubstanz genotoxisch ist.
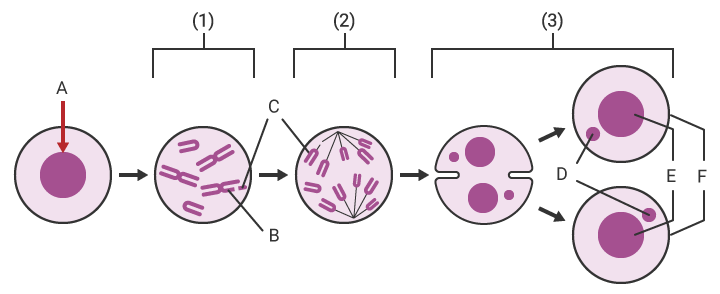
- A
- Verabreichung der Testsubstanz
- B
- Chromosomenbruch
- C
- Fragment
- D
- Mikrokern
- E
- Tochterkern
- F
- Tochterzelle
- (1) Metaphase: Wenn die einem Säugetier oder den kultivierten Zellen eines Säugetiers verabreichte Testsubstanz mutagen ist, tritt eine Chromosomenaberration, wie z. B. ein Chromosomenbruch, auf.
- (2) Anaphase: Die Zellteilung schreitet fort, wobei das Chromosomenfragment in der Zelle verbleibt.
- (3) Telophase: Chromosomenfragmente, die nicht in die Tochterkerne eingebaut wurden, bleiben separat als Mikrokerne in den Tochterzellen.
- * Einige Mikrokerntests verwenden Cytochalasin B, um die Teilung in Tochterzellen während der Telophase zu verhindern. In solchen Fällen bilden sich während der Telophase zwei Kerne und zwei Mikrokerne im Inneren der Zelle.
Die Genotoxizität wird anhand von Chromosomenaberrationen beurteilt, indem die während der Telophase gebildeten Mikrokerne mit dem Mikroskop nachgewiesen werden. Für die mikroskopische Betrachtung wird in der Regel eine Fluoreszenzfärbung oder eine Giemsa-Färbung verwendet. Da die Größe von Mikrokernen etwa 1 μm beträgt, ist es schwierig, sie bei der Betrachtung mit einem Mikroskop mit hoher Vergrößerung unter zahlreichen normal geteilten Zellen zu finden und erfordert fachlich qualifizierte Anwender.
Typische Genotoxizitätstests, die in Kombination mit Mikrokerntests durchgeführt werden
Im Folgenden werden typische Genotoxizitätstests vorgestellt, die zur Beurteilung genotoxischer Eigenschaften, wie z. B. DNA-schädigender und klastogener Eigenschaften, verwendet werden sowie der Mikrokerntest, bei dem Chromosomenaberrationen durch Verabreichung einer Testsubstanz untersucht werden. In einigen Fällen wird zur Erhöhung der Beurteilungsgenauigkeit ein Mikrokerntest mit einem Genotoxizitätstest mit einer anderen Testmethode und anderen Nachweismerkmalen kombiniert.
Comet-Assay
Ein Comet-Assay ist ein In-vivo-Assay, bei dem eine einzelne Zelle auf frühe DNA-Schäden untersucht wird, und wird auch als Einzelzell-Gelelektrophorese-Assay bezeichnet. Bei diesem Assay wird die isolierte Zellprobe in einem alkalischen Gel elektrophoretisch untersucht. Liegt eine DNA-Schädigung im Zellkern der Probenzelle vor, kann ein kometenähnliches Muster von DNA-Brüchen und Migration beobachtet werden. Der größte Unterschied zum in-vivo-Mikrokern-Assay ist die Möglichkeit, aufgrund der Verwendung einer einzelnen Zelle auf DNA-Schäden zu testen, ohne dass eine Zellteilung des untersuchten Zielorgans erforderlich ist. Ein weiteres Merkmal ist, dass ein Comet-Assay die Beurteilung mit einer Vielzahl von Organen und Geweben, einschließlich sich nicht teilender Zellen, ermöglicht. Comet-Assay hat eine hohe Sensitivität für genotoxische Karzinogene und eine hohe Spezifität für nicht karzinogene Substanzen.
Eine Kombination aus Comet-Assay und Mikrokerntest unter Verwendung desselben Tieres wird als sinnvolle Testmethode angesehen, mit der sowohl die Anzahl der für den Test verwendeten Tiere als auch die Testdauer reduziert werden kann.
Test auf Chromosomenaberrationen
Ein Chromosomenaberrationstest ist ein In-vitro-Assay, bei dem Chromosomenaberrationen durch Verabreichung einer Testsubstanz an kultivierte Säugetierzellen, wie z. B. CHL/IU in der Proliferationsphase, oder an eine Chromosomenprobe aus menschlichen Lymphozyten untersucht werden. Der größte Unterschied zu Mikrokerntests, die die Bildung von Mikrokernen in der Telophase untersuchen, besteht darin, dass Chromosomenaberrationstests anhand von Chromosomenproben in der Metaphase nach dem Vorhandensein von Chromosomenaberrationen suchen. Zu den Chromosomenaberrationen, die mit diesem Test nachgewiesen werden, gehören strukturelle Aberrationen, wie z. B. Deletionen (Bruch in einem der Chromatiden) und reziproke Translokationen (Segmente von zwei verschiedenen Chromosomen wurden ausgetauscht) und numerische Aberrationen, wie z. B. ein zusätzliches Chromosom oder das Fehlen eines Chromosoms.
Wird als Ergebnis des Chromosomenaberrationstests, der auf Chromosomenaberrationen in der Metaphase prüft, keine Mutagenität festgestellt, kann als sekundärer Screeningtest ein Mikrokerntest zur Untersuchung der Telophase durchgeführt werden.
Ames-Test
Der Ames-Test, auch Rückmutationstest an Bakterien genannt, ist ein Test zum Nachweis von genotoxischen Karzinogenen. Eine Mutationsinduktion wird festgestellt, wenn eine Testsubstanz einem autotrophen Mutantenstamm verabreicht wird, der selbst keine Aminosäuren produzieren kann, und die Mutagenität der Testsubstanz diesem ermöglicht, Kolonien zu bilden, indem er zu prototrophen Stämmen zurückkehrt, die Aminosäuren produzieren können. In einem In-vitro-Test mit Salmonella typhimurium oder Escherichia coli werden diese Bakterien auf einer weichen Agarplatte kultiviert, die keine Aminosäuren enthält. Die Kolonien werden gezählt, um anhand des Anteils der Platten mit Kolonien festzustellen, ob sie positiv oder negativ sind.
Bei Tests speziell zur Identifizierung genotoxischer Karzinogene kann bei positivem Ergebnis des Ames-Tests (Nachweis von Genmutationen) ein In-vivo-Mikrokerntest als sekundärer Screening-Test verwendet werden.
Betrachtung von Mikrokernen mit einem Fluoreszenzmikroskop
Im Allgemeinen wird bei der Betrachtung von Mikrokernen in einem Mikrokerntest ein Mikroskop zur optischen Betrachtung, manuellen Zählung und Messung verwendet. Um jedoch statistisch gültige Daten für einen Mikrokerntest zu erhalten, muss eine signifikante Anzahl von Zellen bei hoher Vergrößerung in einem breiten Sichtfeld betrachtet werden. Das Heraussuchen und manuelle Zählen der bis zu 1 μm kleinen Mikrokerne unter einer Vielzahl normal geteilter Zellen aus mehreren vergrößerten Bildfeldern erfordert eine hohe Fachkompetenz und ist zudem sehr zeit- und arbeitsaufwändig.
Betrachtung von Mikrokernen mit dem Fluoreszenzmikroskop BZ-X
Das kompakte Fluoreszenzmikroskop BZ-X ermöglicht eine einfache mikroskopische Betrachtung von Genotoxizitätstests, z. B. Mikrokerntests. Die Bildzusammensetzungs-Funktion, die Bilder mit hoher Vergrößerung automatisch als zusammengesetzte Bilder erfassen kann, bietet problemlos hochauflösende Bilder über ein großes Sichtfeld. Mit nur einem Klick auf das Navigationsbild auf dem Monitor kann der Anwender die Bereiche, die er sehen möchte, einfach in einem vergrößerten oder breiten Sichtfeld anzeigen lassen und auf diese Weise Mikrokerne schnell entdecken und betrachten.
Die maskierte Messfunktion und die Funktion zur Spezifikation der Zielobjektgröße der hybriden Zellzählung können Mikrokerne leicht extrahieren und quantifizieren, was nicht nur den Arbeitsaufwand reduziert, sondern auch eine deutlich schnellere Erfassung der Testergebnisse ermöglicht.
Die im BZ-X verwendete hochempfindliche, gekühlte CCD-S/W-Kamera ist optimal für die hochauflösende Fluoreszenzmikroskopie geeignet und kann für optimale Hellfeldbetrachtung schnell in den Farbbetrachtungsmodus umgeschaltet werden. Dadurch unterstützt das BZ-X eine Vielzahl von Tests, darunter Mikrokerntests, Comet-Assays oder Genotoxizitätstests. Das BZ-X reduziert die Kosten und den Platzbedarf für Geräte im Labor und kann dank seiner eingebauten Dunkelkammer auch in einer hellen Umgebung eingesetzt werden, was eine flexible Installation und Nutzung ermöglicht.
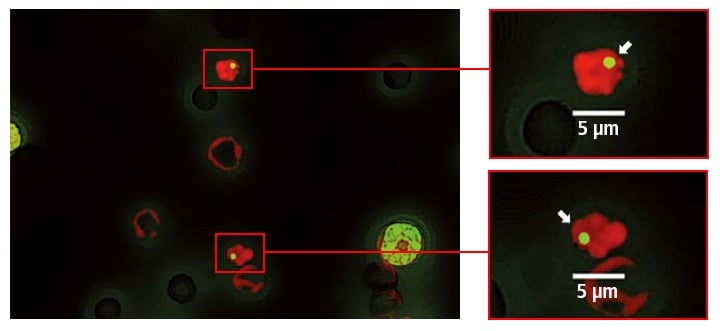
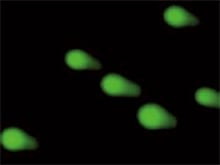
Die Bildzusammensetzung und Quantifizierung kann auch für den Comet-Assay, eine Form des Genotoxizitätstests, eingesetzt werden.
- Verwendung des kompakten Fluoreszenzmikroskops BZ-X
-
- Die Bildzusammensetzungsfunktion erfasst automatisch hochauflösende Bilder mit breitem Sichtfeld.
- Anwender müssen Mikrokerne nur durch Betrachtung der aufgenommenen hochauflösenden Bilder mit großen Sichtfeld auf dem Monitor finden, was den Arbeitsaufwand deutlich reduziert.
- Die maskierte Messfunktion und die Funktion zur Spezifikation der Zielobjektgröße der hybriden Zellzählung können Mikrokerne leicht extrahieren und quantifizieren, wodurch sich der Zeitaufwand für die Ermittlung der Testergebnisse erheblich verringert.
- Neben der hochauflösenden Fluoreszenzmikroskopie bietet das BZ-X auch Hellfeldbetrachtung durch Umschalten in den Farbbetrachtungsmodus, sodass es eine Vielzahl von Mikroskoptests unterstützt.
- Da das Mikroskop keine separate Dunkelkammer für die Fluoreszenzmikroskopie benötigt, kann es überall aufgestellt werden. Darüber hinaus bietet das BZ-X eine Vielzahl von Betrachtungsmöglichkeiten in einem einzigen Gerät an. Dies spart Platz durch einen reduzierten Bedarf an unterschiedlichen Mikroskopsystemen.
- Weitere Beispiele für den Einsatz des kompakten Fluoreszenzmikroskops BZ-X in der Forschung:
- [Myelodysplastische Syndrome (MDS)] Stitching, Sectioning und die Z-Stapelfunktion als entscheidende Argumente für die Anschaffung des Fluoreszenzmikroskops BZ am Universitätsklinikum Düsseldorf
- [Neuropathologie] Perfekte Lösung für den diagnostischen Alltag in der Krankenversorgung und der klinischen Forschung am Institut für Neuropathologie der Charité in Berlin
- [Regenerative Medizin] Essentielle Bildgebung für die Betrachtung der gesamten Wirbelsäule
- [Gentherapie] Probenbetrachtung in der Hirnforschung
- [Behandlung von Herzkrankheiten] Einfache Betrachtung vom gesamten Rattenherz bis hin zu dessen Zellen
- [Krebsbehandlung] Fluoreszenzmikroskop mit integrierter Dunkelkammer verändert die Forschung in starkem Maße
- [Immunsystem] Beitrag der Modellreihe BZ zum Verständnis des pathologischen Asthmamodells
- [Biomaterialien] Förderung der Effizienz in der Forschung mit kompakten, benutzerfreundlichen Mikroskopen