Fluoreszenzmikroskop mit integrierter Dunkelkammer verändert die Forschung in starkem Maße

- Dr. Hideyuki Saya
-
Professor der Medizinischen Fakultät der Universität Keio
Dr. Ph.D., Abteilung für Genregulation, Institut für fortgeschrittene medizinische Forschung
- Untersuchung des Entstehungsprozesses von Krebs und Metastasierung unter Verwendung künstlicher Krebsstammzellen mit dem Ziel einer geeigneten Methode zur Medikamentenentwicklung
- 01. Untersuchung des Entstehungsprozesses von Krebs durch Verwendung von Krebsstammzellen
- 02. Therapieforschung basierend auf dem Konzept des molekularen Targeting
- 03. Zellbasiertes Arzneimittelscreening
- 04. Erfolgreiche Produktion von induzierten Krebsstammzellen (iCSC)
- 05. Fluoreszenzmikroskop mit integrierter Dunkelkammer verändert die Forschung in starkem Maße
- 06. Modellreihe BZ trägt zur Verbesserung der Forschungseffizienz bei
- 07. Klare Bilder durch Unschärfereduktion
- 08. Erfassung aller Bilder für wissenschaftliche Veröffentlichungen
- 09. Möglichkeit grundlegender Veränderungen in der Krebsbehandlung
- Allgemeines: Induzierte Krebsstammzellen (iCSC)
- Über Dr. Hideyuki Saya
Untersuchung des Entstehungsprozesses von Krebs und Metastasierung unter Verwendung künstlicher Krebsstammzellen mit dem Ziel einer geeigneten Methode zur Medikamentenentwicklung
Dr. Hideyuki Saya erforscht in der Abteilung für Genregulation, am Institut für fortgeschrittene medizinische Forschung der Medizinischen Fakultät der Universität Keio, Krebstherapien im Zusammenhang mit den molekularen Mechanismen der Krebsentstehung und bösartigen Transformationen. Als erster Professor des Instituts möchte Dr. Saya zur Prävention, Diagnose und Behandlung von Krebs und anderen refraktären Krankheiten beitragen, indem er das Wissen und die Techniken, die durch zunehmende Erkenntnisse aus der Grundlagenforschung entwickelt wurden, auf die klinische Medizin anwendet. Seine Bemühungen konzentrieren sich auf die Grundlagenforschung zur Behandlung von Hirntumoren und anderen krebsartigen Läsionen unter Verwendung biologischer Ansätze, bei denen das molekulare Targeting im Mittelpunkt steht.
01. Untersuchung des Entstehungsprozesses von Krebs durch Verwendung von Krebsstammzellen
Eine Krebserkrankung entsteht, wenn bei den mit Wachstumsstillstand, Zelltod und Alterung verbundenen Mechanismen Probleme auftreten, die aufgrund von instabilen Genen durch Mutationen in Tumorsuppressorgenen und die Aktivierung von Onkogenen in fortpflanzungsfähigen Zellen hervorgerufen werden.
Bisher ging man davon aus, dass ein Krebsgewebe ein Klumpen von Zellen ist, die sich endlos vermehren, aber in der jüngsten Forschung hat sich gezeigt, dass es zwei Arten von Krebszellen gibt. Eine Art wird als Krebsstammzellen bezeichnet. Diese Zellen besitzen eine Selbsterneuerungsfunktion und können fast permanent Nachkommenzellen produzieren. Der andere Typ umfasst die Mehrheit der Krebszellen und verliert schließlich die Fähigkeit, sich zu vermehren. Mit anderen Worten, es wurde festgestellt, dass auch Krebszellen in einer ähnlichen Beziehung stehen wie normale Stammzellen und Vorläuferzellen.
Ein Merkmal der Krebsstammzellen, das die Krebsbehandlung erschwert, ist ihr langsamer Zellzyklus, welcher die Anfälligkeit dieser Zellen für Krebsmedikamente und Bestrahlung verringert. Das bedeutet, dass selbst dann, wenn die meisten Krebszellen durch die Chemotherapie absterben, die Krebsstammzellen noch immer überleben. Dadurch ist eine vollständige Heilung von Krebs nicht möglich.
Dr. Hideyuki Saya, Professor an der Medizinischen Fakultät der Universität Keio, untersucht den Kontrollmechanismus des Zellzyklus und der Zelladhäsion mit einem zellbiologischen Ansatz zur detaillierten Analyse und überprüft die Ergebnisse anhand von Tiermodellen. Seine Forschung zielt darauf ab, die Mechanismen der Krebsentstehung, Invasion und Metastasierung auf molekularer Ebene zu verstehen.
02. Therapieforschung basierend auf dem Konzept des molekularen Targeting
Nach seinem Abschluss an der Medizinischen Fakultät der Universität Kobe wollte Dr. Saya Neurochirurg werden, um Hirntumore behandeln zu können. Er sah sich jedoch mit der Realität konfrontiert, dass 95% der Patienten mit bösartigen Hirntumoren innerhalb von zwei Jahren sterben. Aufgrund der Grenzen der heutigen Chemotherapie und chirurgischen Behandlung beschloss er, die Forschung an einer Universität aufzunehmen, um einen entsprechenden Behandlungsansatz zu finden. Dennoch wurde ihm klar, dass eine riesige Hürde zur Heilung von Hirntumoren existiert, wie er es ausdrückt: „Während ich an der Universität promovierte, fand ich fast nichts bezüglich der Behandlung.“
Nach Abschluss seines Doktorandenprogramms begann Dr. Saya 1987 sein Studium am Hirntumorzentrum der Universität von Kalifornien in San Francisco (UCSF). Da das UCSF-Hirntumorzentrum die weltweit am weitesten fortgeschrittene Krebsbehandlung erforschte, wollte er sich hier über die neuesten und aktuellsten Techniken und Behandlungen informieren. Am UCSF arbeitete Dr. Saya an der genetischen Analyse von Hirntumoren und konzentrierte seine Bemühungen auf die Erforschung molekularer Targets mit dem Ziel, einen Behandlungsansatz zu finden. Zu dieser Zeit war das Konzept der „molekularen Targets“ noch ein progressiver Ansatz und gab Dr. Saya wichtige Anregungen, die zu seiner späteren Arbeit führten.
Im folgenden Jahr wurde Dr. Saya zum Assistenzprofessor an der Neuro-Onkologie-Abteilung des Krebsforschungsinstituts (MD Anderson Cancer Center) der Universität von Texas ernannt. Da diese Einrichtung das größte Krebsbehandlungsinstitut in den Vereinigten Staaten darstellte, war Dr. Saya an der Krebsforschung zahlreicher Krebsarten, einschließlich Hirntumoren, beteiligt.
1994 übernahm Dr. Saya als erster Professor den Grundlagenforschungskurs über Tumore namens „Medizinischer Onkologiekurs“ an der Medizinischen Fakultät der Universität Kumamoto.
An der Universität Kumamoto begann er mit der Erforschung der Zellzyklen verschiedener Krebsarten, darunter auch Hirntumore. Der Zellzyklus ist ein Prozess, bei dem aus der Zellteilung geborene Tochterzellen zu Mutterzellen heranwachsen, die sich weiter in neue Tochterzellen teilen. Dr. Saya konzentrierte sich darauf, die Funktionsweise des Krebszellzyklus zu erforschen, die Aufschluss darüber gibt, wie die Proliferation von Krebszellen gestoppt werden kann. Deshalb führte er rasch eine Methode zur Beobachtung der Zellteilung im Zeitraffer ein, und leistete intensive Grundlagenforschung. Er begründete diesen Ansatz damit, dass er während seines Studiums in den USA zahlreiche Fälle gesehen hatte, in denen „die Forschung in der Medikamentenentwicklung fast unweigerlich zusammenbrechen würde, wenn man nur die angewandte Forschung betrachtet, ohne Grundlagenforschung zu betreiben“.
03. Zellbasiertes Arzneimittelscreening
Während Dr. Saya in der Arzneimittelforschung, die auf den bereits erwähnten Zellteilungsmechanismus abzielt, großartige Ergebnisse erzielt hat, ist er auch für seine Forschungen über das Zelladhäsionsmolekül CD44 bekannt. CD44 ist ein Molekül, das Zellen aneinander heftet, und nach Dr. Sayas Forschungsergebnissen ist es vermutlich das Schlüsselmolekül bei der Metastasierung von Tumoren. Indem wir dieses Molekül kontrollieren, können wir möglicherweise die Invasion und Metastasierung von Krebszellen blockieren.
Auf der Grundlage dieses zweigleisigen Ansatzes, der weltweit an der Spitze der Krebsforschung steht, strebt Dr. Saya die Entwicklung eines molekularen Targeting-Medikaments an, das gegen Hirntumore und andere refraktäre Krebsarten wirksam ist. Während die Forschung auf diesem Gebiet weltweit allmählich voranschreitet, hat noch kein Forschungsinstitut ein System zur Prüfung der Wirksamkeit von Medikamenten unter Bedingungen, wie die von lebenden Organismen, eingerichtet. Dr. Saya sagt: „In-vitro*-Experimente, die auf kultivierten Tumorlinien basieren, haben gezeigt, dass Auswirkungen durchaus vorhanden sind. Unsere größte Herausforderung in der Forschung ist es jedoch, zu untersuchen, was tatsächlich im menschlichen Körper vor sich geht. Wenn es uns gelingt, diese Mauer zu überwinden, haben wir einen riesigen Schritt in Richtung Arzneimittelscreening gemacht.“
Die Forschung mit biomimetischen Modellen ist jedoch nicht einfach. Einfach ausgedrückt: Während die Umgebung einer Zellkulturplatte zweidimensional ist, ist ein lebender Organismus dreidimensional. Letzterer hat verschiedene verflochtene Strukturen, die den Krebszellen viele Schlupfwinkel bieten. Die Wirksamkeit eines Medikaments variiert je nach Anwendungsgebiet. Die entscheidende Frage ist, wie dieses Problem der Heterogenität überwunden werden kann. Ein Schlüsselpunkt in der Forschung ist die Frage, wie man eine einem lebenden Organismus ähnliche Umgebung mit Hilfe einer In-vitro-Methode, bei der Zellen verwendet werden, reproduzieren kann.
Bisher war es üblich, bei der Herstellung eines Enzymhemmers ein Screening nur mit dem Enzym im Reagenzglas durchzuführen. Im Gegensatz dazu testet das Labor von Dr. Saya die Wirksamkeit von Medikamenten auf Zellbasis. Bei diesem Ansatz werden Zellen unter speziellen Bedingungen kultiviert, um einen pathologischen Zustand zu reproduzieren, der in einem lebenden Organismus auftritt. Diese Zellen werden dann verwendet, um Veränderungen zu beobachten, die durch Wirkstoffpräparate verursacht werden. In den letzten Jahren hat sich die Art und Weise, wie die Arzneimittelforschung betrieben wird, drastisch verändert, wie die Arbeiten von Dr. Saya veranschaulichen. Dr. Saya weist darauf hin, dass sich das Arzneimittelscreening derzeit von enzymbasierten auf zellbasierte Techniken verlagert.
* in vitro: Experimentelle Umgebung in einem Reagenzglas. Der Gegenbegriff wird als „in vivo“ bezeichnet, d. h. eine Umgebung innerhalb eines lebenden Organismus.
04. Erfolgreiche Produktion von induzierten Krebsstammzellen (iCSC)
Die jüngste Forschung, an der Dr. Saya gearbeitet hat, ist die Analyse zur Kontrolle der Zelldifferenzierung und die Entwicklung neuer Krebsmedikamente mit induzierten Krebsstammzellen, die von der japanischen Wissenschafts- und Technologiebehörde als Kernforschung für Evolutionswissenschaft und -technologie (CREST) übernommen wurde. Durch Anwendung der iPS-Zellproduktionstechnik hat Dr. Saya normale Mauszellen gentechnisch verändert und sie erfolgreich dazu gebracht, sich zu Krebsstammzellen (iCSC: induced cancer stem cell) zu entwickeln, die Selbsterneuerungs-, Differenzierungs- und tumorerzeugende Fähigkeiten besitzen.
Dr. Saya beabsichtigt, den Mechanismus der Tumorbildung mit Hilfe verschiedener iCSCs zu erforschen und gleichzeitig Wirkstoffpräparate und Antikörper zu screenen, die die Tumorgenese kontrollieren können. Gegenwärtig werden Mäuse verwendet, aber letztendlich sollen iCSCs aus normalen menschlichen Zellen erzeugt werden, die als Targets für die Entwicklung von Krebsbehandlungsmitteln dienen.
In der neuesten Forschung, die auf der Krebsstammzellen-Theorie basiert, wird der Einsatz von Medikamenten erwogen, die getrennt auf die nachkommenden Krebszellen und die Krebsstammzellen abzielen. Dabei handelt es sich um einen therapeutischen Ansatz, bei dem zunächst die Nachkommenzellen mit Medikamenten abgetötet werden und anschließend die Krebsstammzellen - an denen zuvor keine therapeutischen Medikamente wirkten - mit einem anderen Medikament bekämpft werden. Forscher gehen davon aus, dass dieser Ansatz die Möglichkeit bietet, den therapeutischen Nutzen maßgeblich zu verbessern.
05. Fluoreszenzmikroskop mit integrierter Dunkelkammer verändert die Forschung in starkem Maße
Angesichts der aktuellen Trends hin zu einer verstärkten Ausrichtung auf eine zellbasierte Forschung zur Krebsbehandlung erwähnt Dr. Saya, dass die Bildbetrachtung zunehmend mehr an Bedeutung gewinnt und die Rolle der Mikroskope immer wichtiger wird. Er sagt: „Die dreidimensionale Betrachtung ist entscheidend, um die Veränderungen in Krebszellen gründlich zu untersuchen. Auch das Zählen der Krebszellen zusätzlich zur mikroskopischen Betrachtung ist notwendig, um die Heterogenität zu verifizieren. Gefragt sind Mikroskope, die sowohl die schnelle Betrachtung als auch die Messung unterstützen.“
Dank seiner langjährigen Erfahrung im Bereich der zellbasierten Forschung, die bis in seine Schulzeit zurückreicht, betont Dr. Saya, dass Fluoreszenzmikroskope unverzichtbare Forschungsinstrumente waren und sind. Er blickt auf die Schwierigkeiten der Vergangenheit zurück: „Jeden Tag schloss ich mich zur Beobachtung für mehr als 3 Stunden in eine Dunkelkammer ein. Wenn ich Bilder von Zellen skizzierte, leuchtete ich mit einer Taschenlampe auf meine Hände. Diese Aufgabe war jedoch ineffizient, ganz zu schweigen davon, dass sie meine Augen belastete.“
Aus diesem Grund war er überrascht, als er das Fluoreszenzmikroskop der Modellreihe BZ von KEYENCE zum ersten Mal bei einer Präsentation während seiner Tätigkeit an der Universität Kumamoto kennenlernte. „Die Möglichkeit, auf dem Monitor statt durch ein Okular beobachten zu können, war revolutionär. Wir haben uns für die Modellreihe BZ entschieden, weil wir viele Anfragen von Studenten erhalten haben, die sie verwenden wollten.“
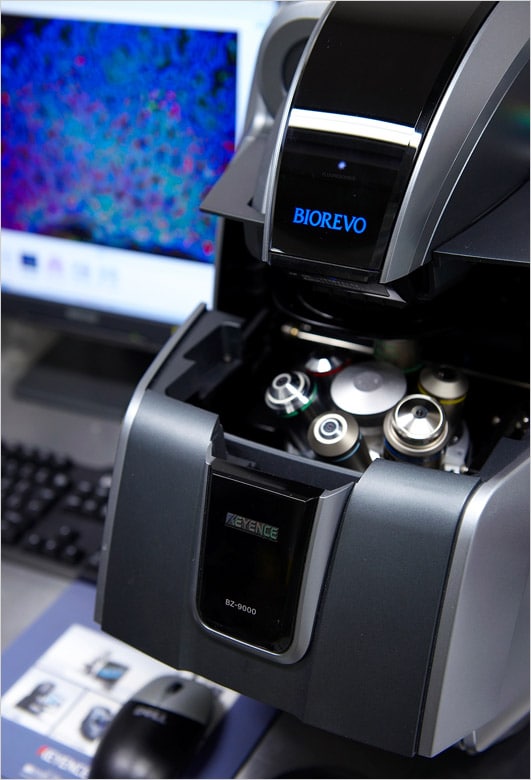
Die Ergebnisse sahen wir kurz nach der Installation der Modellreihe BZ. Dr. Saya denkt über Betrachtungen nach, die mit der Modellreihe BZ in der Hellfeldmikroskopie einfacher werden. „Ein weiterer großer Vorteil war, dass ich Erklärungen zu wichtigen Punkten und Anweisungen zu Experimenten geben konnte, während ich mit einer Gruppe von Studenten auf den Monitor schaute. Bei Mikroskopen, die nur mit Okularen ausgestattet sind, war dies undenkbar.“
Zwar werden in der derzeitigen Medikamentenforschung meist Wirkstoffpräparate für das Screening identifiziert, dennoch ist ein effizientes Screening nach wie vor unerlässlich, da die Anzahl der geeigneten Substanzen im Bereich von bis zu Zehntausenden liegen kann. Man kann durchaus sagen, dass die Aufnahme von Bildern und die schnelle Beobachtung von der Qualität des Mikroskops abhängen.
Der Austausch von Informationen in Bildungseinrichtungen ist laut Dr. Saya sehr wichtig. Er erwähnt ebenso, dass er die Zellbilder absichtlich deutlich auf dem Monitorbildschirm angezeigt lässt. Dadurch wird sichergestellt, dass solche Bilder von den Studenten im Labor gesehen werden. Ihr Interesse steigt und sie erkennen, wie wichtig eine klare Bilderfassung ist, und werden dadurch motiviert, dies selbst genauso zu tun. Laut Dr. Saya führt „der Austausch von Forschungsergebnissen durch Bilder zu einem verbesserten Forschungsniveau des gesamten Labors.“
- Das Fluoreszenzmikroskop BZ verfügt über viele weitere innovative Funktionen
- Informieren Sie sich in unserem Katalog über das neue kompakte Fluoreszenzmikroskop BZ-X von KEYENCE.
06. Modellreihe BZ trägt zur Verbesserung der Forschungseffizienz bei
Eines der wichtigsten Entscheidungskriterien für Dr. Saya bei der Auswahl eines Forschungsinstruments ist, ob es dazu beiträgt, die Forschung zu beschleunigen. Gleichzeitig berücksichtigt er aber auch, wie viele Forscher im Labor es nutzen können oder wollen. Dr. Saya berichtet: „In diesem Sinne verwendet fast jeder im Labor die Modellreihe BZ. Ich schätze das Mikroskop sehr, weil es trotz seiner häufigen Verwendung zuverlässig und ohne mechanische Ausfälle arbeitet.“
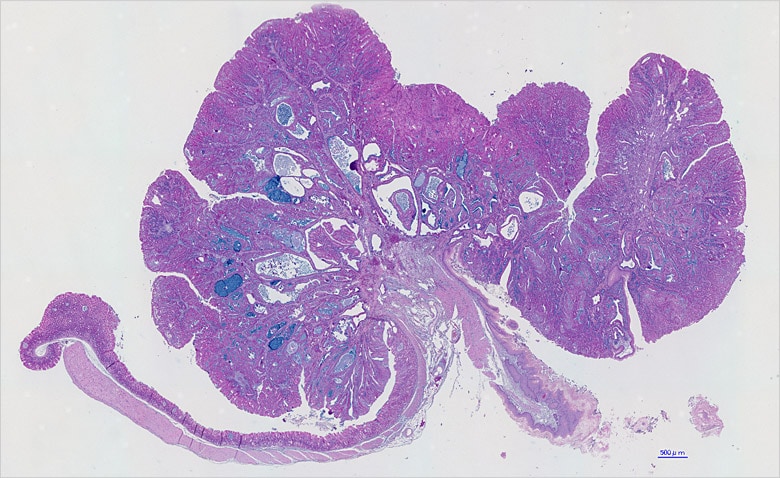
Für die zellbasierte Betrachtung der Invasion und Metastasierung von Krebszellen einer Maus müssen zusammenhängende Abschnitte eines Organs untersucht werden. Für jedes Organ sind zwanzig bis dreißig Streifenpräparationen notwendig. Diese Anzahl lässt sich mit klassischen Okularmikroskopen in kurzer Zeit nicht verarbeiten. Mit dem Mikroskop BZ können jedoch alle Bildaufnahmen in etwa einer Stunde abgeschlossen werden.

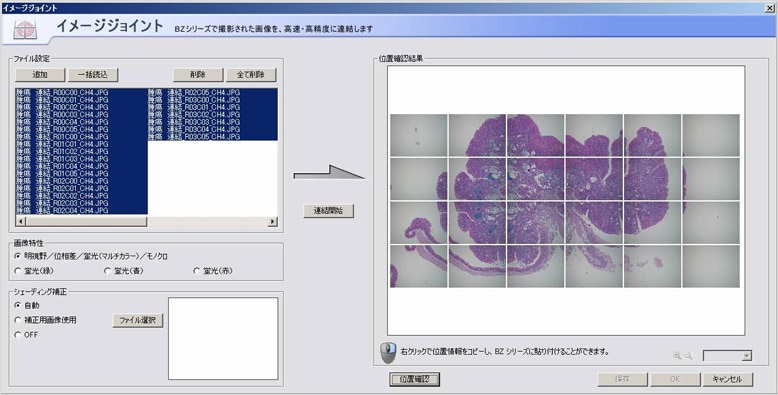
Dr. Saya schätzt auch die Bildzusammensetzungsfunktion, die Bilder nach einer großflächigen Aufnahme schnell und nahtlos zusammenfügt. „Wenn ich Bilder auf einer akademischen Konferenz veröffentliche, bekomme ich oft Fragen von den anwesenden Forschern, wie ich sie aufgenommen habe“, sagt Dr. Saya.
Für eine detaillierte Untersuchung der Krebszellproliferation ist eine dreidimensionale Beobachtung in einer biomimetischen Umgebung erforderlich. Zudem ist der XYZ-Achsen-Objekttisch für eine Betrachtung mit vertikaler Achse nützlich.
Dr. Saya fügt auch hinzu, dass er häufig die Zellzählfunktion verwendet, um zu messen, wie viele Krebszellen in einer bestimmten Dichte enthalten sind. Diese Funktion wird in der heutigen Zeit, in der Beobachtungen quantifiziert werden müssen, immer wichtiger.
- Das Fluoreszenzmikroskop BZ verfügt über viele weitere innovative Funktionen
- Informieren Sie sich in unserem Katalog über das neue kompakte Fluoreszenzmikroskop BZ-X von KEYENCE.
07. Klare Bilder durch Unschärfereduktion
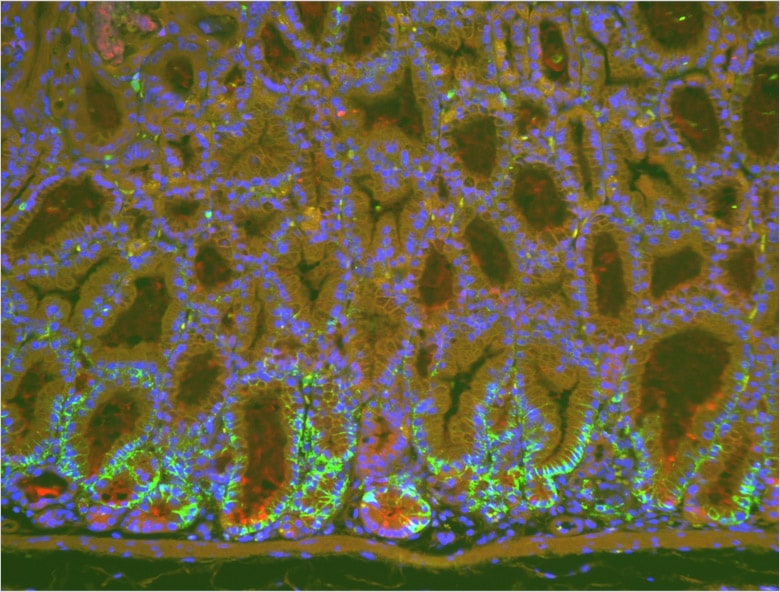
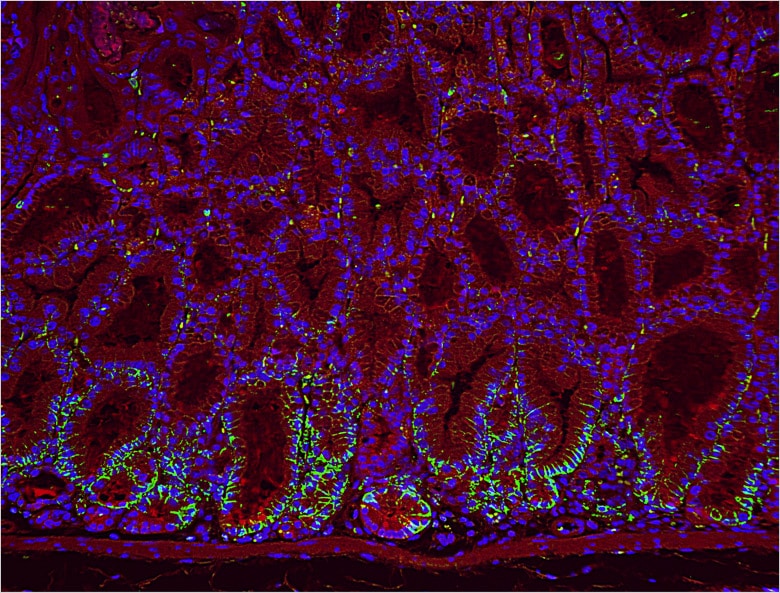
Auch Wissenschaftler Dr. Takatsugu Ishimoto verwendet häufig die Modellreihe BZ im Labor von Dr. Saya. Gegenwärtig erforscht er die Entwicklung von Magenkrebs. Kürzlich wurde die Beteiligung von Helicobacter pylori als Ursache von Magenkrebs identifiziert, aber sein Mechanismus im lebenden Organismus ist noch nicht vollständig erforscht. Durch die Forschung an transgenen Mäusen versucht Dr. Ishimoto, auf molekularer Ebene den Mechanismus zur Entstehung von Magenkrebs zu entschlüsseln.

Dr. Ishimoto verwendet die Modellreihe BZ zur Beobachtung des gesamten Mäusemagens und ebenso Teilabschnitte davon.
„Bisher war die Beobachtung von Gewebeabschnitten mit einem Fluoreszenzmikroskop nicht einfach zu bewerkstelligen - es war weit weniger zugänglich bzw. verfügbar als heute. Wenn man etwas beobachten wollte, musste man zunächst die Objektträger mit den Proben vorbereiten und diese dann schnell in die Dunkelkammer eines anderen Gebäudes tragen. Dies war ein großer Kraftakt. Im Hinblick auf dieses Thema ist die Modellreihe BZ sehr hilfreich, da sie direkt im Labor platziert und jederzeit verwendet werden kann, wenn wir sie benötigen.“
Dr. Ishimoto sagt, dass er das Fluoreszenzmikroskop BZ fast täglich benutzt, wenn es viele Experimente durchzuführen gibt.
„Am beeindruckendsten sind die klaren Bilder. Ich finde die Unschärfereduktionsfunktion, welche die Fluoreszenzunschärfe beseitigt, sehr praktisch. Sie kann die Entwicklung der Probenzellen deutlich sichtbar machen und liefert überzeugende Bilder.“
- Das Fluoreszenzmikroskop BZ verfügt über viele weitere innovative Funktionen
- Informieren Sie sich in unserem Katalog über das neue kompakte Fluoreszenzmikroskop BZ-X von KEYENCE.
08. Erfassung aller Bilder für wissenschaftliche Veröffentlichungen
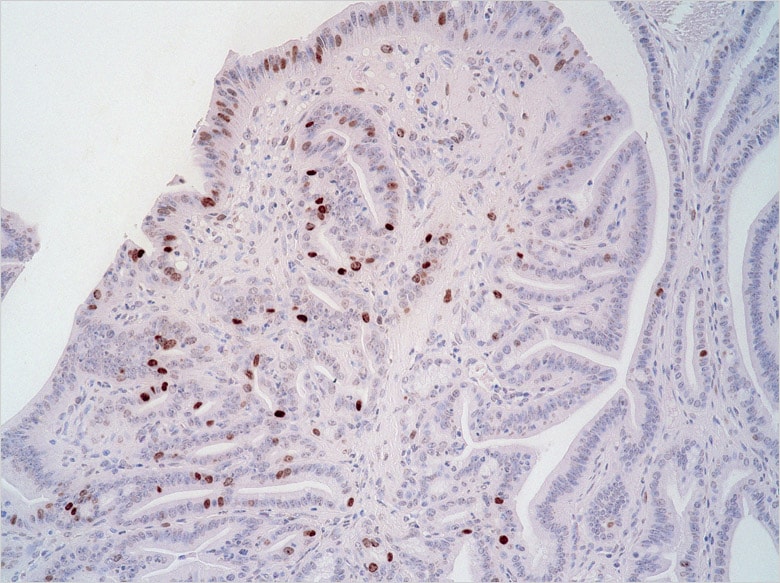
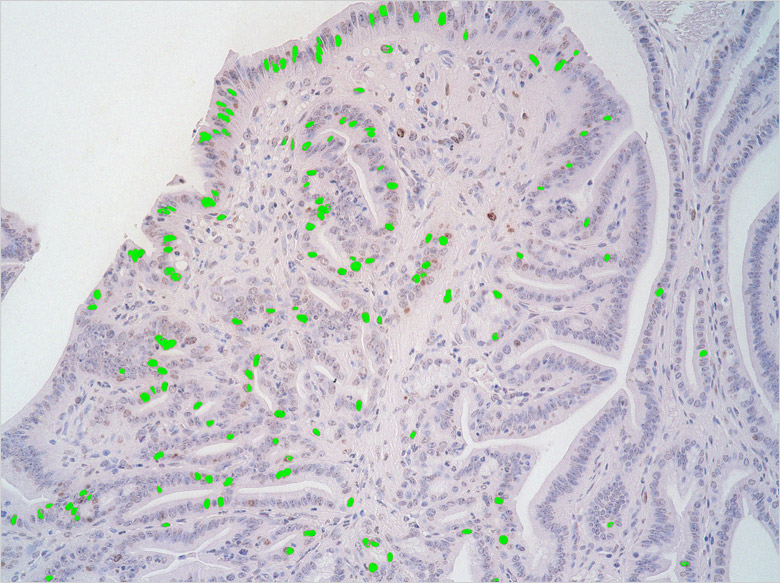
Dr. Ishimoto ist überzeugt, dass die Modellreihe BZ auch zur Rationalisierung der Forschung beiträgt. „Ich verwende die Zellzählfunktion zur Zählung der Probenzellen. Sie ist sehr nützlich, weil die Zählung schnell und genau erfolgt. Früher hielten wir ein Zählgerät in der Hand, um jede Zelle manuell zu zählen, aber das dauerte etwa einen halben Tag. Mit Hilfe der Zellzählfunktion kann dieselbe Zählung in Sekundenschnelle durchgeführt werden.“
Dr. Ishimoto erwähnt auch, dass die Software einfach zu handhaben ist, sodass jeder sie intuitiv benutzen kann.
Das Labor verfügt auch über ein konfokales Mikroskop, das jedoch seit der Anschaffung der Modellreihe BZ selten benutzt wurde. Dr. Ishimoto erklärt: „Da das konfokale Mikroskop unter den Labormitgliedern gemeinsam genutzt wird, müssen wir zunächst eine Reservierung vornehmen, was bedeutet, dass wir es nicht zu jedem gewünschten Zeitpunkt sofort benutzen können. Die Modellreihe BZ ist jedoch in greifbarer Nähe und kann jederzeit eingesetzt werden. Darüber hinaus ist sie sehr praktisch, da wir alle für die Forschung erforderlichen Aufgaben - wie Beobachtung, Bilderfassung und Zellzählung - mit nur einem einzigen Instrument erledigen können“. Dies sind nur einige der vielen Vorteile, die der Einsatz der Modellreihe BZ mit sich bringt.
Dr. Ishimoto arbeitet derzeit an der Fertigstellung seiner wissenschaftlichen Veröffentlichung für die Präsentation auf einer Fachkonferenz. Die für die Präsentation verwendeten Bilder wurden alle mit der Modellreihe BZ aufgenommen.
„Der Entstehungsmechanismus von Magenkrebs und anderen gastroenterologischen Krebsarten ist noch nicht vollständig erforscht. Andererseits gibt es Fortschritte in der Forschung zu Brustkrebs und Leukämie. Persönlich möchte ich zur Krebsbehandlung beitragen, indem ich den Entstehungsprozess von gastroenterologischen Krebsarten aufkläre.“
- Das Fluoreszenzmikroskop BZ verfügt über viele weitere innovative Funktionen
- Informieren Sie sich in unserem Katalog über das neue kompakte Fluoreszenzmikroskop BZ-X von KEYENCE.
09. Möglichkeit grundlegender Veränderungen in der Krebsbehandlung

Dr. Sayas zellbasierte Forschung mit den induzierten Krebsstammzellen (iCSC) hat das Potenzial, zur Screening-Standardmethode für die Entwicklung neuer Krebsmedikamente zu werden. Abgesehen von Krebs gilt sie auch als vielversprechender Ansatz für genetische Krankheiten und Stoffwechselkrankheiten.
Dr. Sayas höchstes Bestreben ist es, eine Behandlung für Hirntumore und andere refraktäre Krebsarten zu entdecken. Er hofft, eine Grundlage für Ärzte zu schaffen, damit weltweit die gleichen medikamentösen Therapien angeboten werden können. „Mein Traum ist es, Hirntumore mit oraler Medikation heilbar zu machen“, sagt Dr. Saya.
Der zukünftige Fortschritt in der Spitzenforschung mit iCSC wird die Entstehungsprozesse von Krebs entschlüsseln und das Konzept der Krebsbehandlung bedeutend verändern. Krebs, derzeit die Todesursache Nummer eins, könnte eines Tages nicht mehr eine unheilbare Krankheit sein.
(Stand: März 2009)
Allgemeines: Induzierte Krebsstammzellen (iCSC)
Eine induzierte Krebsstammzelle ist eine Krebsstammzelle, die durch Anwendung der iPS-Zellproduktionstechnik künstlich hergestellt wird. Es ist möglich, induzierte Krebsstammzellen (iCSC) zu erzeugen, die einen bösartigen Tumor hervorrufen, indem die hämatopoetischen Zellen und die Stromazellen des Knochenmarks einer Maus gentechnisch verändert werden. iCSC wird wesentlich zur Entwicklung von Krebsmedikamenten beitragen. iCSC könnte auch nützlich sein, um die zugrunde liegenden Entstehungsprozesse von Krebs zu verstehen, was derzeit eine ungelöste Frage in der klinischen Anwendung von iPS-Zellen ist.
Über Dr. Hideyuki Saya
Dr. Hideyuki Saya wurde 1956 geboren. Er schloss 1987 ein Doktorandenprogramm an der Medizinischen Fakultät der Universität Kobe ab. Nach seiner Medizin-Promotion studierte er 1987 als Postdoktorand am UCSF-Hirntumorzentrum. Im Jahr 1988 wurde er dann zum Assistenzprofessor am Krebsforschungsinstitut (MD Anderson Cancer Center) der Universität von Texas ernannt. Von 1994 bis 2006 war er Professor für medizinische Onkologie an der Medizinischen Fakultät der Universität Kumamoto, bevor er 2007 seine derzeitige Position als Professor am Institut für fortgeschrittene medizinische Forschung der Medizinischen Fakultät der Universität Keio annahm. Dr. Saya ist auf Tumorbiologie spezialisiert. Er hat viele Auszeichnungen erhalten, darunter den „Hoshino Memorial Lecture Award“ (2000), den „Victoria Jursnich Carhart Memorial Lecture Award“ (2000) und den „Deborah M. Richman Memorial Lectureship“ (2001).